DNA重组修复是细胞内最重要的生命过程之一,主要包括错配修复(Mismatch repair, MMR)、碱基切除修复 (Base excision repair, BER)、核酸切除修复 (Nucleotide excision repair, NER)和同源重组修复(Homologous recombinational repair, HRR)。目前,MMR、BER和NER相对比较清楚,来自美国、瑞典和土耳其的三位科学家(Paul Modrich,Tomas Lindahl和Aziz Sancar)因分别揭示了以上三种不同DNA修复机制而共享了2015年度的诺贝尔化学奖。HRR则相对更为复杂,其修复途径及其调控机制都不十分清楚。然而,同源重组修复HRR与人类重大疾病包括癌症的发生、诊断和治疗密切相关,它也是研发分子生物技术如基因编辑的理论基础之一。
古菌DNA HRR系统和真核生物有共同的起源但是又有不同于真核生物和细菌的特点。山东大学微生物技术国家重点实验室申玉龙课题组翟斌元博士生等利用遗传、生化和质谱分析等方法,从超嗜热泉古菌冰岛硫化叶菌(Sulfolobus islandicus REY15A)中发现并鉴定了一种新型ATP酶/解旋酶, 命名为PINA(PIN domain-containing ATPase)。生化性质分析表明,PINA能够结合复制叉和Holliday junction(HJ)等分支DNA,并且与HJ解离酶Hjc、RecQ类解旋酶Hjm和复制因子C小亚基(RFCs)等具有相互作用, 促进Hjc对HJ 的解离,改变其切割HJ方向的偏好性,同时抑制Hjm的解旋酶活性。课题组与美国加利福利亚大学Li Fan博士和微生物技术国家重点实验室的谷立川教授合作,成功地解析了PINA蛋白的晶体结构。综合体外生化性质分析、蛋白晶体结构分析和课题组前期结果及国际上的研究进展,提出了PINA、Hjm和Hjc三种蛋白协同作用,参与停滞复制叉修复和HRR途径的作用机制和模型(图一),为进一步研究古菌及真核生物的同源重组修复介导的停顿复制叉的修复开启了一个新的窗口。
相关关成果发表在Nucleic Acids Research (https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gky451/5017765?guestAccessKey=792f9606-01ba-48dc-a187-47211c5baddf)和Journal of Molecular Biology (PMC5565510)等期刊上。
以上研究得到国家自然科学基金重点项目(30930002)和面上项目(31470184和31670061)的资助。(文/图 作者:黄奇洪)
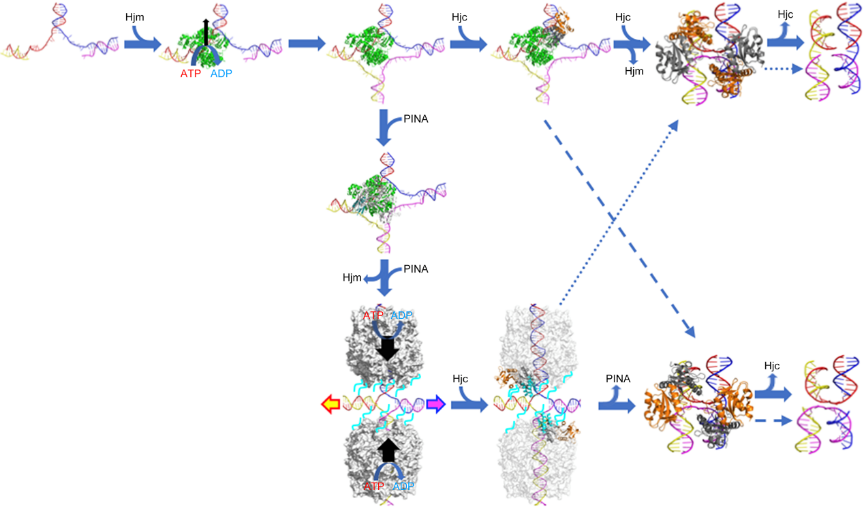
Hjm、PINA和Hjc协同作用加工停顿复制叉和Holliday junction的模型

