6月17日,山东大学微生物技术国家重点实验室(研究院)李盛英教授课题组在免疫抑制一线药物麦考酚酸的生物合成机制研究方面取得突破,相关研究成果以“Compartmentalized Biosynthesis of Mycophenolic Acid”为题在线发表于TOP期刊《美国科学院院报》(PNAS)。微生物技术国家重点实验室(研究院)张伟教授为论文唯一第一作者,李盛英教授为论文唯一通讯作者。山东大学微生物技术国家重点实验室(研究院)为第二通讯单位。
麦考酚酸 (Mycophenolic Acid, MPA)及其衍生物(如:吗替麦考酚酸酯、麦考酚钠等)是临床应用多年的一线免疫抑制药物,年销售额超过10亿美元,广泛用于器官移植和自身免疫性疾病的治疗。来源于短密青霉(Penicillium brevicompactum)的麦考酚酸是人类历史上首个获得分离和结晶的抗生素,自1893年被发现以来,其生物合成途径成为长期困扰微生物天然药物领域的重大难题。
李盛英课题组在前期研究中从一株短密青霉NRRL864的基因组中成功捕获了麦考酚酸生物合成基因簇(ChemBioChem. 2015, 16: 565-569),在此基础上综合运用基因敲除、异源表达、前体饲喂、酶体外功能重建与蛋白亚细胞荧光定位等技术手段,在国际上首次彻底解析了麦考酚酸的生物合成途径,揭示了该途径中独特的生物合成与生物降解偶联以及复杂的区室化合成过程,从而破解了麦考酚酸生物合成的“百年谜题”。该成果不仅将为通过菌株理性遗传改造降低麦考酚酸的工业生产成本提供全新的理论依据,而且也将为未来设计、改造和开发更加高效、安全的新一代免疫抑制剂奠定基础,可望产生显著的社会和经济效益。
在麦考酚酸生物合成途径中,定位于细胞质的聚酮合酶MpaC’和甲基转移酶MpaG’,定位于内质网的P450单加氧酶/水解酶MpaDE’和氧化酶MpaB’,定位于高尔基体的法尼烯基转移酶MpaA’以及定位于过氧化物酶体的酰基CoA合酶PbACL891、酰基CoA水解酶和β-氧化酶系通过精巧的分工合作得以实现麦考酚酸的高效特异性合成。真菌天然产物的区室化生物合成是含有细胞器的高等生物所具有的独特机制,但目前关于丝状真菌次级代谢途径的区室化研究十分有限。李盛英课题组发现麦考酚酸生物合成步骤的区室化可将不同的酶和底物作为功能单元限制在特定的亚细胞空间,如此一来不仅可通过生物催化反应的亚细胞定位产生必要的反应选择性优势,而且中间产物的空间隔离亦可有效防止其非特异性反应和细胞毒性。鉴于高等生物(真菌、植物)天然产物对工业生产、公共卫生和食品安全等方面的重要性,区室化生物合成研究模式的建立必将对更加深入地理解真菌细胞次级代谢产物的生产和调控以及真菌细胞的系统发育过程产生重要影响。
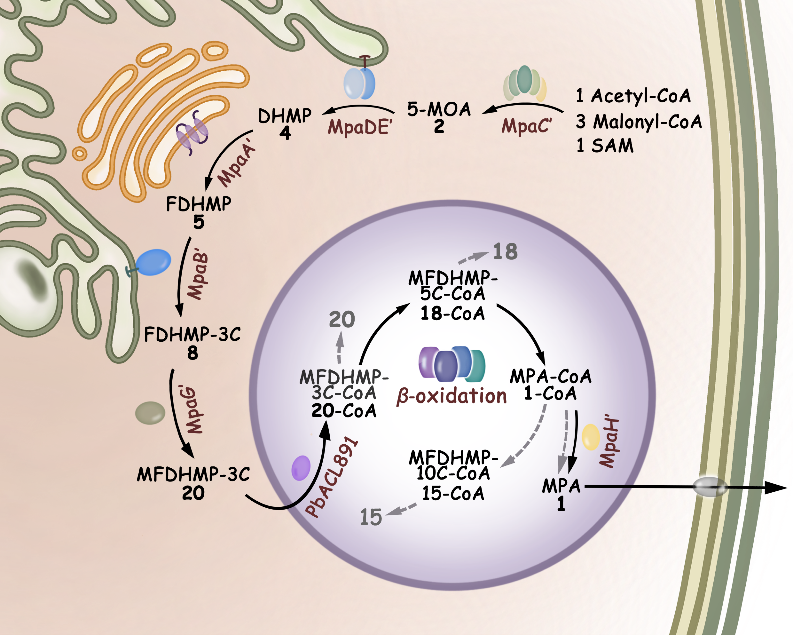
麦考酚酸(MPA)的区室化生物合成途径
该研究工作得到了山东大学杰出青年学者、山东大学齐鲁青年学者项目,微生物技术国家重点实验室启动经费,以及国家自然科学基金(21472204,31570030,81741155)等经费支持。山东大学微生物技术国家重点实验室生命科学共性研究技术平台为本工作中关键化合物的结构表征提供了重要支持。
论文链接:https://www.pnas.org/content/early/2019/06/14/1821932116

