7月29日,山东大学微生物技术国家重点实验室佘群新教授团队与哥本哈根大学蛋白质研究中心Guillermo Montoya教授团队合作,在Molecular Cell(《分子细胞》)杂志在线发表了题为“Structure of the Cmr-β Complex Reveal the Regulation of the Immunity Mechanism of Type III-B CRISPR-Cas”的研究论文。山东大学佘群新教授与和哥本哈根大学蛋白质研究中心Guillermo Montoya教授为该研究的共同通讯作者,Guillermo Montoya组的Nicholas Sofos(博士后)与佘群新组冯明霞(博士后)为共同一作。山东大学微生物技术国家重点实验室为第二通讯单位。该项研究工作得到了转基因国家重大研发计划项目、国家自然科学基金委面上项目等基金的资助。
该研究通过Cryo-EM手段解析了来自嗜热古菌-冰岛硫化叶菌(Sulfolobus islandicus, Sis)的Cmr-β复合物(Cmr蛋白和crRNA)的七种不同状态的三维结构。该研究结合结构解析与生化实验数据阐释了III-B型Cmr-β复合物避免自身免疫与同源靶标RNA激活免疫的机制。
CRISPR-Cas系统是原核生物中由小RNA介导的获得性免疫系统,用于抵御外源移动遗传元件1-3。根据复合物中的标志Cas蛋白,CRISPR-Cas系统被划分为I~VI型,其中I、III和VI型的RNP复合物含多种不同功能的Cas蛋白,归类为Class 1;而II、IV和V型只有单体多功能的Cas蛋白,归类为Class 2 4。 III型系统具有多种免疫活性,分别为靶标RNA间隔6碱基切割活性,同源靶标RNA激活的单链DNA切割活性与环状寡聚腺苷酸(cyclic oligoadenylates, cOA)合成活性5,6。III-A(Csm)与III-B(Cmr)系统作为III型系统目前发现的两个大亚类型,现只有报道研究III-A型复合物被同源靶标RNA激活的分子机理7-9,但对于III-B型复合物的系统性机理研究目前还缺乏。

该研究从冰岛硫化叶菌中纯化内源完整的Cmr-β复合物。该复合物解析得到2.75Å的Cryo-EM结构,该结构展示了Cmr-β复合物由7种不同亚基,共37个亚基和一条crRNA组成,组成成分比例为Cmr11-21-31-44-53-61-726-crRNA1。研究人员发现,与其他III型复合物不同的是,Cmr-β复合物的中心结构中的每个亚基均被由两个Cmr7形成的二聚体覆盖(如图1E和F)。该III-B型复合物是目前发现的亚基数最多,分子量最大的复合物。
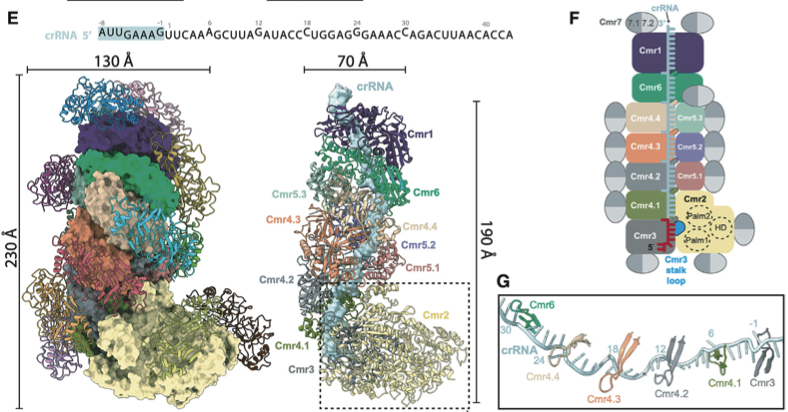
图1. 冰岛硫化叶菌SisCmr-β冷冻电镜电镜结构
目前发现的III型系统具有的同源靶标RNA激活的活性是单链DNA切割活性和cOA合成活性。该研究首次发现,除了以上两种激活活性,Cmr-β复合物还同时具有非特异性单链 RNA 切割活性。
先前的研究表明,III-A型的Csm复合物通过Cas10家族蛋白—Csm1中的一个Linker和loop L1结构参与区分同源和非同源靶标RNA7。然而这些结构在III-B型的Cas10蛋白—Cmr2中并不保守。为了理解III-B复合物如何区分同源靶标RNA和非同源靶标RNA,避免自身免疫机制,研究人员纯化了靶标RNA切割活性失活的突变体(4βD31A-β),并解析了该突变体+非同源靶标RNA或同源靶标RNA的Cryo-EM结构(3.1 Å和3.5 Å)。通过结构比较发现,存在于Cmr3中的一个颈环(stalk loop)在这三个结构中呈现不同的构象:在复合物结构里呈现“延伸”,复合物结合非同源靶标RNA后发生旋转,呈“回缩”,结合同源靶标RNA后,消失“不可见”。通过序列比对发现,这个颈环结构保守的存在于III-B系统中。该研究指出,III-B复合物与非同源RNA结合后,其crRNA 5’ tag和非同源RNA 3’ antitag互补配对后,Cmr3中的颈环锁定在“回缩”状态,传达一种“自我”的信号,从而避免自身免疫。
为了进一步揭示同源靶标RNA激活Cmr-β复合物免疫的分子机制(即cOA合成,单链核酸切割),研究人员解析了4βD31A-β复合物+同源靶标RNA+AMP-PnP(ATP类似物),并得到了两种状态的Cryo-EM结构,简称AMPPnP1(2.41Å)和AMPPnP2(2.68Å)。在此复合物的基础上再加上一条单链polyT DNA,同样得到了两种Cryo-EM结构(polyT1,3.07Å和polyT2,3.14Å)。在这些结构中,Cmr3颈环结构呈现不同的构像变化,“延伸”、“回缩”和“不可见”。
综上所述,不同状态下的多种结构中的颈环结构的构象变化表明,Cmr-β复合物在结合同源靶标RNA后,颈环结构在“延伸”和“回缩”的构型间交替,这种动态平衡似乎控制着Cmr2的活性,从而控制着免疫反应。
总体而言,该研究通过冷冻电镜技术解析了冰岛硫化叶菌中的Cmr-β复合物与不同底物结合后的七种高分辨率结构,结合生化实验数据表征该III-B CRISPR-Cas系统结合靶标RNA后,颈环结构的构象变化参与机体避免自身免疫以及响应免疫的机制。该研究为全面了解多样性的III型CRISPR-Cas系统的免疫机制蓝图增添了一份贡献。
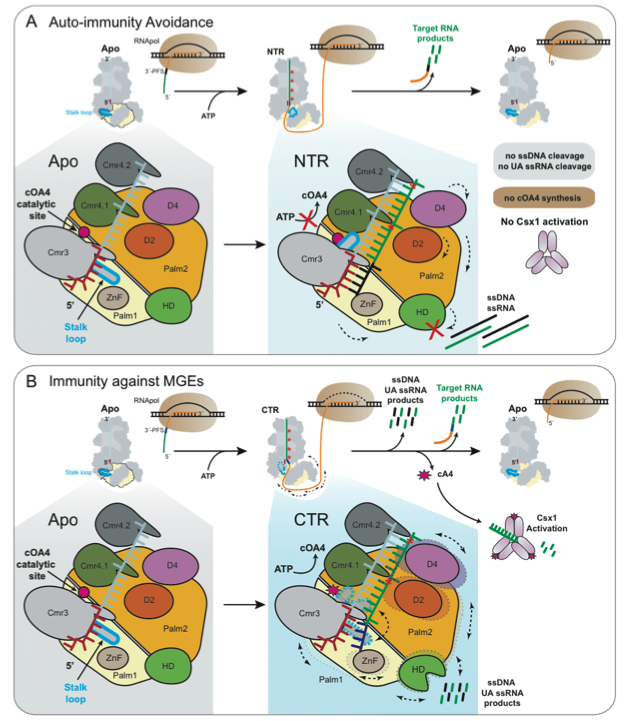
图2. III-B型SisCmr-β复合物免疫机理模型
原文链接:
https://doi.org/10.1016/j.molcel.2020.07.008

