基因克隆技术是生物学研究最基本的方法之一,基于PCR的克隆技术一般很难突破10kb。基因组文库构建耗时费力,而且柯斯质粒(Cosmid)文库无法克隆超过45kb的片段,细菌人工染色体(BAC)文库虽然可以获得大于200kb的基因组DNA,但是只有专业实验室才能实现。直接克隆技术可以将基因组中的DNA大片段直接捕获到载体上,避免了繁琐的DNA文库构建工作,意义重大。山东大学微生物技术国家重点实验室张友明团队长期致力于DNA直接克隆技术的研发工作,取得了一系列重要进展。
大肠杆菌λ噬菌体重组蛋白 Redα(核酸外切酶),Redβ(单链DNA退火蛋白)可以高效介导线性DNA和环状DNA之间发生同源重组。张友明教授利用Red重组蛋白开发的Recombineering技术不受DNA分子大小和限制性酶切位点的制约,可以从大肠杆菌染色体上将任意大小的基因组DNA片段克隆到载体上,该技术于1998年发表在Nature Genetics【1】。

Recombineering技术还可以用于细菌染色体和质粒的修饰,是基因工程领域的一个里程碑,是DNA大分子遗传修饰的必备技术,已经广泛应用于真核和原核生物的基因敲除和转基因等领域。由于Red重组蛋白介导的线环重组必需依赖于DNA复制体系,所以它只能从大肠杆菌基因组上克隆DNA片段。
为了突破基因组DNA直接克隆技术对物种的限制,山东大学符军教授通过研究发现Rac前噬菌体重组蛋白RecE和RecT能够高效介导线性DNA分子之间发生同源重组。基于RecET重组酶建立的DNA直接克隆技术能从纯化的细菌基因组上将50kb以内的DNA片段直接捕获到表达载体上。RecET直接克隆技术于2012年作为封面文章在Nature Biotechnology发表(图1) 【2】。应期刊编辑邀请,美国著名合成生物学家Huimin Zhao在同期Nature Biotechnology发表了题为Direct cloning of large genomic sequences的评论。同时,Nature Methods编辑Tal Nawy博士在Nature Methods发表了题为Capturing sequences for bioprospecting的评论。RecET直接克隆技术极大地便利了微生物生物合成途径的克隆和异源表达研究。
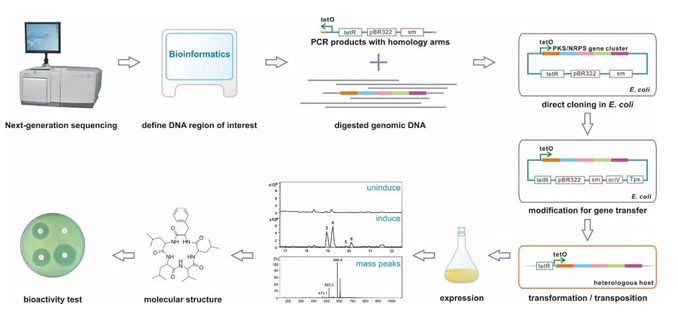
图1 利用Red/ET重组技术进行基因组挖掘
为了给微生物生物合成资源的开发提供更加便利的方法,张友明课题组学生王海龙和李振将RecET系统和Redαβ系统整合到一个宿主中,并通过克隆载体和修饰元件的标准化,实现了生物合成途径克隆、转移和异源表达的无缝对接,一个载体可以适用于细菌接合转移,转座和位点特异性重组等不同遗传操作手段,据此撰写的详尽实验指导于2016年发表在Nature Protocols(图2) 【3】。该论文得到了评审专家的高度肯定:“Before entering into the details asked by the Review, I would like to state that I really enjoyed the reading of this clever piece of science.”

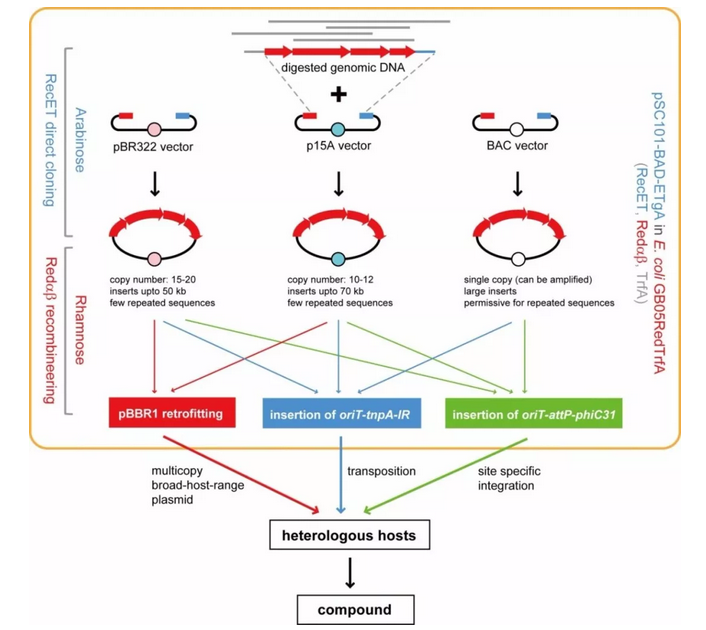
图2 生物合成途径高通量直接克隆、转移和异源表达。
RecET直接克隆技术的局限性在于不能从细菌基因组中克隆大于50 kb的DNA片段或者从哺乳动物(比如小鼠和人)中克隆大于10 kb的基因组片段,其原因在于RecET直接克隆技术要求克隆载体和目的基因组DNA片段必须同时进入一个大肠杆菌细胞内并相遇才能发生同源重组。王海龙围绕如何促使克隆载体和目的DNA片段同时进入一个大肠杆菌细胞开发的ExoCET(Exonuclease Combined with RecET recombination)直接克隆技术成功实现了大于100 kb细菌基因组DNA的直接克隆,而且能高效地从小鼠和人的基因组直接克隆大于50 kb的DNA片段(下表) 【4】。

ExoCET直接克隆技术将体外重组和体内重组相结合,T4 DNA聚合酶的核酸外切酶活性可以促进克隆载体和目的基因组DNA片段在体外进行退火,从而显著提高其共同进入一个大肠杆菌克隆宿主的几率,细胞内表达的RecET重组酶可以将只完成了一端退火的重组DNA分子(占体外反应产物的85%)通过另一端的同源臂进行退火,从而形成完整的重组质粒。
为了探索ExoCET技术克隆宏基因组DNA的可行性,研究人员将目标细菌的基因组DNA用其它细菌的基因组DNA稀释1000倍,成功从1 ng的目标基因组DNA中克隆了一个14kb的DNA片段,体外和体内重组相结合的威力彰显。从小鼠基因组中克隆一个45kb的片段时,研究人员发现商业化的Gibson组装系统会产生大量自身环化的载体而造成很高的克隆背景导致克隆失败,但是ExoCET则可以获得32%的克隆效率。
张友明教授团队开发的ExoCET克隆技术不仅有利于微生物生物合成资源的开发,而且可以用于动物基因打靶载体构建和基因型分析,同时也为个体基因诊断和治疗提供了新的手段,该研究成果已申请中国发明专利和PCT国际发明专利,并于2017年12月发表于Nucleic Acids Research【4】。

参考文献:
1.Zhang, Y., Buchholz, F., Muyrers, J.P. and Stewart, A.F. (1998) A new logic for DNA engineering using recombination in Escherichia coli.Nat. Genet., 20, 123-128.
2.Fu, J., Bian, X., Hu, S., Wang, H., Huang, F., Seibert, P.M., Plaza, A., Xia, L., Müller, R., Stewart, A.F. et al. (2012) Full-length RecE enhances linear-linear homologous recombination and facilitates direct cloning for bioprospecting.Nat. Biotechnol., 30, 440-446.
3.Wang, H., Li, Z., Jia, R., Hou, Y., Yin, J., Bian, X., Li, A., Müller, R., Stewart, A.F., Fu, J. et al. (2016) RecET direct cloning and Redab recombineering of biosynthetic gene clusters, large operons or single genes for heterologous expression.Nat. Protoc., 11, 1175-1190.
4.Wang, H., Li, Z., Jia, R., Yin, J., Li, A., Xia, L., Yin, Y., Muller, R., Fu, J., Stewart, A.F. et al. (2017) ExoCET: exonuclease in vitro assembly combined with RecET recombination for highly efficient direct DNA cloning from complex genomes.Nucleic Acids Res, 2017 Dec 2020

